新鲜组织冻存半天能不能做ihc:冰冻切片做 mIHC 的方法与技巧
在生物医学研究领域,新技术的突破总能开启新的研究方向。就拿多重荧光免疫组化技术来说,它背后的技术原理和实验操作,就像一座未被开发的宝藏,正等着我们去探索和挖掘。
多重荧光免疫组化技术,也就是mIHC,它的核心技术是TSA,也就是酪酰胺信号放大技术。这技术,主要是用辣根过氧化酶(HRP)来标记靶蛋白或者核酸。在mIHC里,我们是用二抗上的HRP来催化非活性荧光素,而不是直接把它和荧光素连在一起。HRP和过氧化氢一起作用,就能把荧光素激活,和附近的蛋白的酪氨酸残基牢固地结合,这样蛋白样品和荧光素就能稳定地结合在一起了。这个独特的技术方法,就是mIHC能够多标记的基础。而且,这种结合方式在微波处理之后,之前非共价结合的抗体就会被移除,只留下共价结合的荧光素。虽然这项技术还有一些挑战,但是研究者们正在一步步解决这些问题。
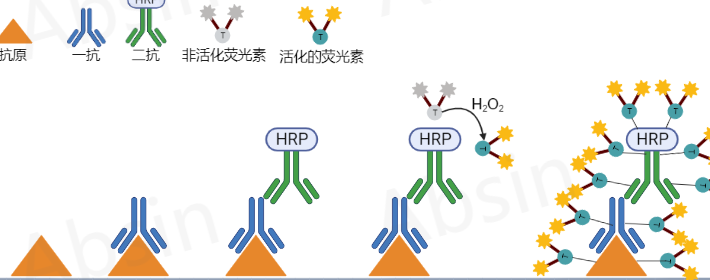
Absin为了让更多科研人员能掌握mIHC技术,推出了抗体洗脱液。这可是个大力推动mIHC技术在科研领域广泛应用的好办法。不少老师都盼着用这种先进的mIHC技术,可是一些技术难题阻碍了它的普及。Absin的抗体洗脱液可能就是解决这些难题的关键。有了它,我们或许能在确保实验准确无误的享受到更加方便高效的实验条件。
做冰冻切片的多色实验,得特别注意好多环节。头一步是固定和包埋,得先弄到新鲜的组织,用4%的多聚甲醛低温固定。固定完得用PBS缓冲液洗三次,每次都得洗足15分钟。这过程中,时间长短、固定剂浓度这些都很关键。多聚甲醛浓度要是差太多,固定效果可能就不好;PBS缓冲液洗的次数和时间长短也会影响到实验结果。像清洗不彻底,可能会留下杂质,影响后续步骤里化学物质的反应。
在完成固定包埋这一步骤的时候,咱们得特别小心,每一个小细节都不能马虎,因为万一出了点差错,就可能影响到实验的整体结果。
切片这事可不能马虎。得用冷冻切片机,把组织切成3到5微米的薄片。要是组织是冻在零下八十度的,那得先挪到零下二十度的冰箱里头,搁那儿平衡个15分钟。切完片,得赶紧贴到防脱载玻片上,室温下晾个30到60分钟。这过程中,切片的厚度得根据实验要求来精确调整。像是一些精密的研究,可能得用更薄的切片,切片厚了,影响荧光标记的准确性,还可能影响后续计算的精确度。晾片的时间也不能随便定,时间短了,样品可能贴不稳;时间长了,样品在后续操作中可能会出别的问题。
实验里孵育这事挺复杂的,有好几步。先得把内源性的过氧化物酶给灭掉,加3%的H₂O₂,室温下孵个10到30分钟,再用PBS洗5分钟,这得来来回回做三次。封闭那步也不能马虎,得加封闭液,室温下孵个30分钟,把封闭液给洗掉。一抗孵育得注意温度和时间,要是避光湿盒里4度孵,就得整夜,37度的话就1到2小时,最后还得用PBS洗三次,每次5分钟。二抗孵育和染料孵育也有各自的要求,包括时间、试剂啥的。这孵育环节可不能出差错,哪一步出了问题,最后结果都可能不对。比如说,一抗孵育温度不对,就可能导致特异性抗原识别不了。
抗体孵化完毕,荧光素全结合好了,咱们就进入最后的检测准备环节。得洗脱抗体,得小心点,得保证把预热到37℃、完全溶解的抗体洗脱液加得正好。新鲜组织冻存半天能不能做ihc,往样品上滴1*DAPI工作液,把样本区浸着,室温孵育个10分钟,再用PBS洗洗。再加抗荧光淬灭封片剂,用盖玻片封好,得小心别让气泡冒出来。要是哪个步骤搞错了,前面的努力可就白费了。那你们在操作的时候,有没有遇到卡壳或者结果跟想象的不一样的情况?欢迎在评论区留言交流,也请大家多多点赞和转发这篇文章。
- 标签:




