蜡烛融化后是什么物质,中考化学专题复习1-3,知识要总结
中考复*,需要将知识汇总融合分类记忆,形成一个知识体系,今天化学姐就帮大家汇总初中化学复*专题,让帮助大家更好的全面复*。

专题一物质的性质、用途、变化及分类
一、物质的性质和用途
1.物质的性质包括
物理性质
化学性质。
2.物理的性质是指通过眼、鼻等感官可以感知或者用仪器可测出的物质的表面性质,它包括颜色、状态、气味、熔点、沸点、硬度、密度、溶解性、挥发性导电性 等方面。
3.化学性质则是指物质的内在性质,它肉眼无法感知,只有通过发生化学变化才能体现出来,它包括可燃性、还原性、氧化性、酸性、碱性、毒性等。
4.物质的性质决定物质的用途。
二、物质的变化及其分类:
1、物理变化和化学变化的区别
(1)从定义上区别:
物理变化后没有新物质生成,如将纸撕成纸条、蜡烛熔化、冰融化成水、石油的蒸馏分离等;但化学变化则有新物质生成,如米饭烧焦变黑有糊味、木柴燃烧、火药爆炸等。所谓新物质是指与原物质的组成或结构不同的物质。
(2)从反应现象上区别:
化学变化过程中常伴随着发光、发热、变色、放出气体、生成沉淀等现象。但不能以此作为判断依据,有些物理变化也有这些现象!如白炽灯丝因通电发热变红而发光就不是化学变化,所以判断时还需综合其他因素作出判断。
2、物理变化和化学变化的联系
化学变化过程中一定有物理变化,如分析蜡烛燃烧这一变化:火柴靠近蜡烛芯时蜡烛融化后是什么物质,烛芯处变软、熔化、燃烧、发光发热、有黑烟。在此过程中,蜡烛变软、熔化是物理变化,燃烧是化学变化,发光发热是伴随的现象。
3、化学变化的四种基本反应类型
(1)化合反应(合)
通式:A+B=AB
例:C+O2=CO2 ;CaO+H2O=Ca(OH)2
(2)分解反应(分)
通式:AB=A+B
例: Cu2(OH)2CO3=2CuO+CO2↑+H2O Cu(OH)2=CuO+H2O
(3)置换反应:(换)
通式:AB+C=CB+A
例: Zn++H2↑
注意:CO++Cu不是置换反应,它不符合定义中“一种单质和一种化合物”这一句,该反应的反应物由两种化合物组成。
(4)复分解反应:(互换成份)
通式:AB+CD=AD+CB
例: 2NaOH+(OH)2↓+
注意:反应:CaCO3++H2O+CO2↑从表面来看不是复分解反应,究其本质,仍属复分解反应:CaCO3++H2CO3
专题二 化学用语及化学量
一、元素符号
元素符号采用该元素拉丁文第一个大写字母代表元素,若第一个字母相同,则把第2个字母小写,若第2个字母相同,则选第3个依此类推!
1、元素符号含义:
①表示一种元素 ②表示该元素的一个原子
2、元素符号周围数字的意义:
如:2O:表示两个氧原子
O2:表示氧气分子,表示1个氧分子由两个氧原子构成。
:氧元素的化合价为-2价
O2-:表示氧离子,表示每个氧离子带两个单位负电荷.
3、常见的离子:
阳离子:K+ 、Ca2+ 、Na+ 、Mg2+ 、Zn2+ 、Al3+ 、Fe3+(铁离子)、
Fe2+(亚铁离子)、Ag+、H+、NH4+(铵根离子)等。
阴离子:Cl-、O2-、S2-、SO42-、NO3-、CO32-、OH-等。
对于常见的原子团,其化合价你应该记住,特别是以下六个原子团:
原子团
PO43-
SO42-
CO32-
NO3-
OH-
NH4+
化合价
-3
-2
-2
-1
-1
+1
二、化学式
1.化学式意义:(1)一种物质及组成该物质的各种元素
(2)这种物质的一个分子及分子的构成
2.化学式书写要求:一种纯净物只用一个化学式来表示。
(1)单质的书写相信你们都非常熟悉
(2)化合物书写四步曲:
①:排序:一般正价在前,负价在后
②:标价:在元素或原子团上方标出化合价
③:交叉:交叉写出原子个数(最简比)
④:检查:正负化合价代数和为零
三.化学方程式
(一)质量守恒定律:(化学反应中的规律)
1.内容:在化学反应中,参加反应的各物质的质量总和等到于反应后生成物的各物质的质量总和。
2.实质:化学反应前后三个不变:①原子种类不变;②原子数目不变;③原子质量不变。(补充:化学反应前后元素种类不变,但分子种类改变。)
3.适用范围:一切化学变化(反应),与物理变化和体积变化没关系。
(二).化学方程式:(化学反应的表示方法)
1、定义:用化学式来表示化学反应的式子。
2、意义:(1)质的方面:表示反应物、生成物和反应条件;(2)量的方面:①表示各物质之间的质量关系;②表示各物质之间的微粒(分子)个数关系。
3、读法:(以2H2+为例)。
(1)氢气与氧气在点燃条件下生成水;(2)两个氢分子和一个氧分子反应生成两个水分子;(3)每4份质量的氢气与32份质量的氧气完全反应生成36份质量的水。
4、写法:
(1)原则:①以客观事实为基础;②遵守质量守恒定律。
(2)步骤:①在短线的左右两边写出反应物与生成的化学式;②配平化学方程式;③标明反应条件及生成物状态,把短线改成等号。
5.根据化学方程式计算:(化学反应中的定量计算)
(1)依据:化学反应中各物质之间以一定的质量比参加反应。
(2)步骤:①设定未知数;②写出相应的化学方程式;③对应写出有关物质的相对分子质量和已知量、未知量;④列出比例式,求解;⑤写出答案。
四、有关化学量
1.相对原子质量:它是一个比值,它与原子的质量不同。
2.相对分子质量:意义同上,都是相对于碳-12(C-12)原子质量的1/12的比值。
专题三 物质的构成奥秘
一、物质构成的奥秘
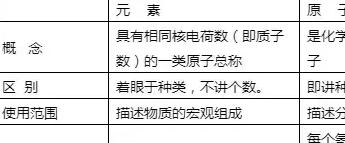
分子与原子的关系:

元素与原子的关系:
二、元素的化合价
1.化合价是元素的性质,有正价和负价,其正负是由元素的原子结构决定的。
2.常见元素的化合价:氢、锂、钾、钠、银显+1价,钡、钙、镁、锌显+2价,氧显-2价,铝显+3价等(某些元素可显几种化合价)。
3.在化合物中,元素的正负化合价的代数和为0(单质分子里元素的化合价也为0)。
4.通过原子团或其他有固定化合价的元素,可求出不易确定的元素的化合价。
- 标签:




